Neuren (NEU) – Annonce ASX du 9 août 2024 : L’essai clinique de phase 2 montre des améliorations significatives dans le syndrome d’Angelman.
Faits Marquants :
- Les mesures globales d’efficacité des cliniciens et des aidants spécifiquement conçues pour le syndrome d’Angelman ont montré un niveau d’amélioration statistiquement significatif par rapport à l’état avant traitement après 13 semaines (test de rang de Wilcoxon p<0,05) et considérée comme cliniquement significative :
- Impression clinique globale d’amélioration (CGI-I) – score moyen de 3,0, avec 11 enfants sur 13 montrant une amélioration évaluée par les cliniciens (p. ex. enfants présentant une amélioration évaluée par les cliniciens (p=0,0010)).
- Impression globale de changement des aidants (CIC) – score moyen de 3,2, avec 8 enfants sur 12 montrant une amélioration évaluée par les aidants (p=0,0273).
- Tous les enfants de la tranche d’âge la plus jeune (3-12 ans) ont montré une amélioration mesurée à la fois par l’échelle CGI-I (score moyen de 2,8 p=0,0078) et le CIC (score moyen de 2,6 p=0,0078).
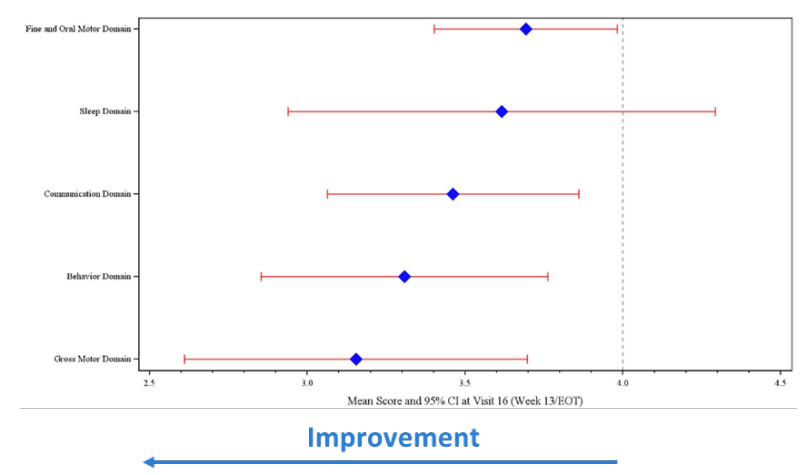
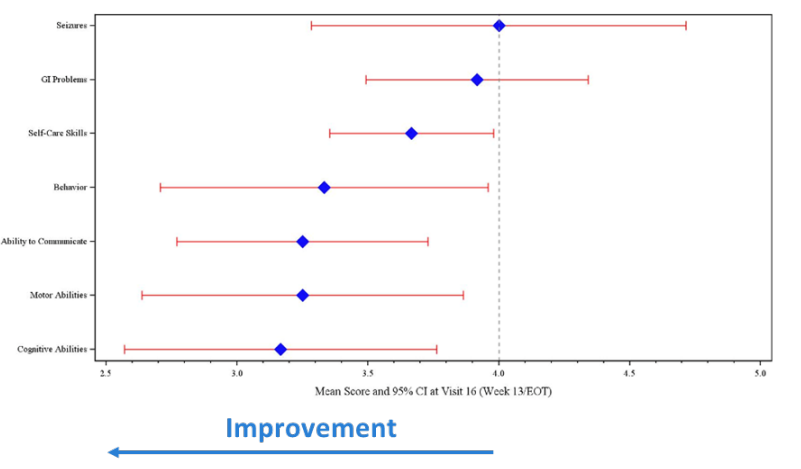
- Des améliorations ont été observées dans les aspects cliniquement importants du syndrome d’Angelman, incluant la communication, le comportement, la cognition et les capacités motrices.
- Le NNZ-2591 s’est avéré sécuritaire et bien toléré en tant que dose liquide orale, sans effets indésirables graves et sans tendances significatives dans les valeurs de laboratoire ou autres paramètres d’innocuité pendant le traitement.
- Les résultats renforcent la confiance dans le potentiel du NNZ-2591 pour améliorer de multiples troubles développementaux.
Melbourne, Australie : Neuren Pharmaceuticals (ASX : NEU) a annoncé aujourd’hui les premiers résultats de son essai clinique de phase 2, le NNZ-2591, chez des enfants atteints du syndrome d’Angelman (SA).
Le NNZ-2591 s’est avéré sûr et bien toléré sous forme de dose liquide orale et des améliorations ont été observées dans des aspects cliniquement importants du syndrome d’Angelman.
Les mesures d’efficacité globale des cliniciens et des aidants, conçues spécifiquement pour le syndrome d’Angelman, ont montré un niveau d’amélioration par rapport à l’état avant traitement qui était supérieur à la moyenne, statistiquement significatif et considéré comme cliniquement significatif.
Il n’existe pas de traitement approuvé pour le SA, malgré son impact très important sur la vie des patients, ainsi que sur leurs parents et leurs frères et sœurs.
Jon Pilcher, PDG de Neuren, a déclaré : « Ces résultats confirment une fois de plus que le NNZ-2591, sous forme de dose orale liquide peut traiter les principaux symptômes de divers troubles du développement neurologique, indépendamment de l’origine génétique sous-jacente. Nous sommes très reconnaissants envers la communauté du syndrome d’Angelman et les sites d’essai en Australie qui ont permis de mener à bien l’essai ».
Conception de l’essai
L’essai de phase 2 en ouvert chez des enfants âgés de 3 à 17 ans (âge moyen de 10 ans) dans trois hôpitaux en Australie a examiné la sécurité, la tolérance, la pharmacocinétique et l’efficacité pendant 13 semaines de traitement avec le médicament NNZ-2591. Les enfants présentant tous les génotypes du SA, à l’exception du mosaïcisme, étaient éligibles pour participer à l’essai.
Le NNZ-2591 a été administré à tous les participants sous la forme d’une dose liquide orale deux fois par jour, avec une escalade en deux étapes jusqu’à la dose cible de 12 mg/kg au cours des 6 premières semaines de traitement, sous réserve d’un examen indépendant des données d’innocuité et de tolérabilité. L’étude a commencé par une période d’observation d’au moins 4 semaines afin de bien définir les caractéristiques de base avant de commencer l’étude. Une évaluation de suivi a été effectuée 2 semaines après la fin du traitement.
Les principaux critères d’évaluation de ce premier essai chez les enfants atteints du SA étaient la sécurité, la tolérabilité et la pharmacocinétique. Les critères d’évaluation secondaires comprenaient des mesures d’efficacité spécifiquement conçues pour le SA, évaluées par les cliniciens et les aidants, ainsi que des mesures d’efficacité qui n’ont pas été conçues pour être utilisées dans le SA mais qui ont été utilisées dans d’autres troubles du développement neurodéveloppemental. L’essai a porté sur 16 participants. Deux participants ont dû interrompre l’étude en raison d’un test positif au COVID-19 et un participant a interrompu l’étude parce qu’il n’a pas été en mesure d’accomplir les procédures de surveillance et de sécurité requises par le protocole de l’étude. Les données de sécurité et de tolérabilité sont présentées pour les 16 participants (population en intention de traiter ou ITT) et et les données d’efficacité sont présentées pour les 13 participants qui ont terminé le dosage (population en intention de traiter modifiée ou mITT).Il n’y avait pas de différence significative dans les données démographiques des populations ITT et mITT.
Sécurité et tolérance
Le NNZ-2591 a été bien toléré et a présenté un bon profil de sécurité. La plupart des événements indésirables étaient légers ou modérés (TEAEs) et la plupart ont été considérés comme n’étant pas liés au médicament à l’étude. Il n’y a pas eu d’effets indésirables graves et aucune tendance significative des valeurs de laboratoire, de l’électrocardiogramme (ECG) ou d’autres paramètres de sécurité n’a été observée pendant le traitement. Les TEAEs survenus chez au moins deux participants sont énumérés dans le tableau ci-dessous.
| Evénement | N=16
n (%) |
Evénement | N=16
n (%) |
| Infection virale | 5 (31) | Bave | 2 (13) |
| Nasopharyngite | 4 (25) | Épistaxis | 2 (13) |
| Convulsion | 4 (25) | Insomnie | 2 (13) |
| Infection des voies respiratoires supérieures | 3 (19) | Pyrexie | 2 (13) |
| Somnolence | 3 (19) | Abrasion cutanée | 2 (13) |
| Constipation | 3 (19) | Infection des voies urinaires | 2 (13) |
| Diarrhée | 2 (13) | Vomissements | 2 (13) |
Efficacité
Les mesures d’efficacité globale des cliniciens et des aidants spécifiquement conçues pour le syndrome d’Angelman ont montré un niveau d’amélioration par rapport à l’état avant traitement qui était statistiquement significatif (test de rang signé de Wilcoxon p<0,05) et considérée comme cliniquement significative. L'amélioration moyenne par rapport à l'état avant traitement était statistiquement significative, qu'elle soit calculée pour les sujets qui ont terminé le traitement (population mITT) ou qu'elle inclue les sujets qui ont abandonné le traitement (population ITT). Des améliorations ont été observées dans des aspects cliniquement importants du syndrome d'Angelman y compris la communication, le comportement, la cognition et les capacités motrices. Impression clinique globale d’amélioration (CGI-I) du SA
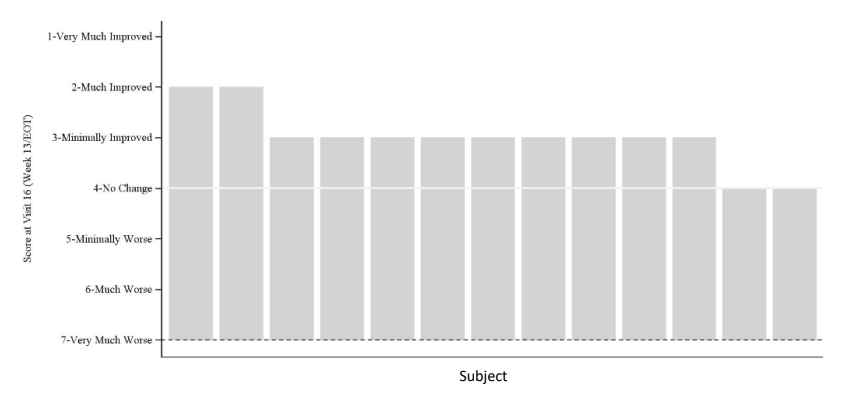
11 enfants sur 13 ont montré une amélioration mesurée par l’Impression clinique globale d’amélioration (CGI-I), une évaluation par le clinicien de l’état général de l’enfant par rapport à l’état initial.
Le score CGI-I moyen était de 3,0 (p=0,0010). Deux enfants ont reçu un score de 2 (« beaucoup mieux »). Dans le groupe d’âge 3-12 ans, les 8 enfants ont montré une amélioration, avec un score moyen de 2,8 (p=0,0078).
Les scores par sujet et par domaine sont présentés dans les figures suivantes :
Score d’impression clinique globale d’amélioration (CGI-I) par sujet à la fin du traitement
Score moyen de l’Impression clinique globale d’amélioration (CGI-I) à la fin du traitement, par domaine
Impression générale de changement de la part de la personne qui s’occupe de l’enfant (CIC)
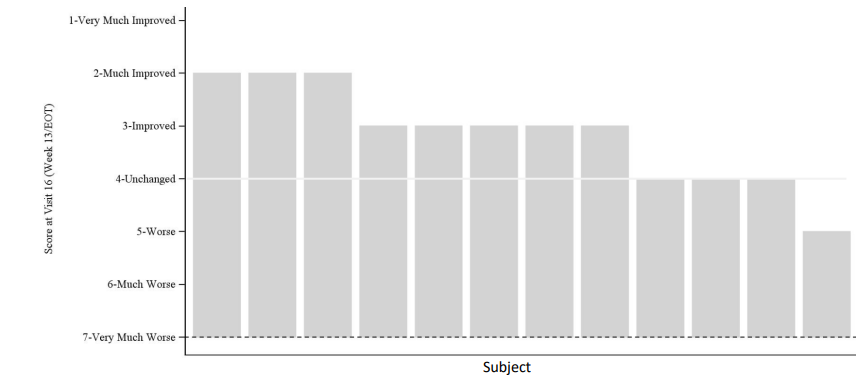
8 enfants sur 121 ont montré une amélioration mesurée par l’Impression globale de changement de l’aidant SA (CIC), une évaluation par l’aidant de l’état général de l’enfant par rapport à la situation de départ. Le score CIC était de 3,2 (p=0,0273). Trois enfants ont reçu un score de 2 (« beaucoup mieux »). Dans le groupe d’âge 3-12 ans, les 8 enfants ont montré une amélioration, avec un score moyen de 2,8 (p=0,0078).
1 score CIC pour un sujet non rempli par inadvertance par l’aidant lors de la visite du site
Les scores par sujet et par domaine sont présentés dans les figures suivantes :
Score d’impression de changement de l’aidant (CIC) par sujet à la fin du traitement
Score d’impression de changement de l’aidant (CIC) par domaine à la fin du traitement
Autres mesures
Quatre enfants ont montré une amélioration mesurée par l’impression clinique globale de gravité (CGI-S), une évaluation par le clinicien de la gravité globale de la maladie de l’enfant, par rapport à l’évaluation de départ.
Les échelles de Bayley pour le développement du nourrisson et du jeune enfant (Bayley-4) ont été incluses dans l’essai en tant que mesures exploratoires de l’efficacité, bien qu’elles soient conçues pour mesurer les résultats sur une période plus longue que la durée de cet essai clinique. Malgré la durée limitée du traitement à 13 semaines, pour chacune des 6 sous-échelles de Bayley, plus de 50 % des enfants ont vu leurs scores bruts s’améliorer.
Développement du NNZ-2591 dans de multiples indications neurodéveloppementales
Neuren développe le NNZ-2591 pour de multiples troubles neurologiques graves d’origines génétiques qui apparaissent dans la petite enfance et pour lesquels il n’existe pas ou peu d’options thérapeutiques approuvées.
En décembre 2023 et mai 2024, des résultats positifs ont été annoncés lors d’essais de phase 2 sur le NNZ-2591 dans les cas suivants : Phelan-McDermid et le syndrome de Pitt Hopkins respectivement. La réunion de fin de phase 2 avec la Food and Drug Administration (FDA) pour le NNZ-2591 dans le syndrome de Phelan-McDermid est prévue en septembre 2024 au cours de laquelle Neuren demandera des conseils sur le reste du programme de développement. En parallèle, la fabrication des fournitures pour la phase 3 est en cours. Neuren a une IND ouverte auprès de la FDA pour le NNZ-2591 dans le syndrome de Prader-Willi et mène également des études précliniques pour le NNZ-2591 dans d’autres indications non divulguées.
À propos du syndrome d’Angelman
Le syndrome d’Angelman (SA) est un trouble neurodéveloppemental rare dont on estime qu’il survient dans un cas sur 10 000 à 20 000 naissances. Il est causé par une perte de fonction du gène UBE3A sur le chromosome 15 de la mère. Le syndrome d’Angelman partage des symptômes et des caractéristiques avec d’autres troubles, ce qui signifie que les erreurs de diagnostic sont fréquentes. Les enfants et les adultes atteints du SA présentent généralement des troubles de l’équilibre, des déficiences motrices et des crises d’épilepsie. Le sommeil perturbé est souvent un challenge important. Certains ne marchent jamais et la plupart ne parlent pas. Les personnes atteintes du SA ont une espérance de vie normale mais elles ont besoin de soins continus et sont incapables de vivre de manière autonome. De plus amples informations sont disponibles à l’adresse suivante www.cureangelman.org et www.angelman.org
À propos de Neuren
Neuren développe de nouvelles thérapies médicamenteuses pour traiter de multiples troubles neurologiques graves qui apparaissent dans la petite enfance et pour lesquels il n’existe pas ou peu d’options thérapeutiques approuvées. Reconnaissant l’urgence des besoins non satisfaits, tous les programmes ont reçu la désignation de « médicament orphelin » aux États-Unis. La désignation de médicament orphelin fournit des incitations pour encourager le développement de thérapies pour les maladies rares et graves.
DAYBUE™ (trofinetide) est approuvé par la Food and Drug Administration (FDA) des États-Unis pour le traitement du syndrome de Rett chez les patients adultes et pédiatriques âgés de deux ans et plus. Neuren a accordé une licence mondiale exclusive à Acadia Pharmaceuticals Inc. pour le développement et la commercialisation du trofinetide.
Le deuxième médicament candidat de Neuren, le NNZ-2591, est en phase 2 de développement pour de multiples troubles du développement neurologique,avec des résultats positifs dans les essais cliniques de phase 2 pour le syndrome de Phelan-McDermid, le syndrome de Pitt Hopkins et le syndrome d’Angelman.
Contact :
investorrelations@neurenpharma.com ; Jon Pilcher, CEO : +61 438 422 271
Informations relatives aux règles de cotation de l’ASX
Le conseil d’administration de Neuren Pharmaceuticals Limited, Suite 201, 697 Burke Road, Camberwell, VIC 3124, a autorisé la transmission de cette annonce à l’ASX.
Déclarations prospectives
Cette annonce contient des déclarations prospectives qui sont soumises à des risques et à des incertitudes. Ces déclarations impliquent des risques connus et inconnus, ainsi que des facteurs importants susceptibles d’influencer les résultats réels, les performances ou les réalisations de Neuren, qui soient matériellement différents des déclarations contenues dans ce communiqué.
| FAST France met à disposition la traduction du communiqué de presse que vous pouvez retrouver ici. En cas d’erreurs, uniquement la version originale en anglais prévaut. |

