Partie 2 : Les thérapies géniques
Explication en vidéo de la méthode CRISPR/Cas 9 pour l’édition génique
3 – Applications actuelles

La sécurité et l’efficacité des thérapies géniques sont au cœur des recherches et des essais cliniques actuels. Ces essais de thérapie génique sont très longs à mettre en place puisqu’ils diffèrent selon les pathologies, dont les besoins et les obstacles ne sont pas les mêmes. De même, la recherche clinique se rythme en plusieurs phases longues [3] pour garantir l’efficacité et la tolérance des futures thérapies mises sur le marché. Néanmoins, plusieurs succès ont été attestés pour différentes pathologies [4].
Dans le cas du Syndrome d’Angelman, les thérapies géniques et innovantes offrent un espoir considérable puisqu’aucune alternative thérapeutique n’existe à ce jour. Lié à la perte de fonction d’un ou plusieurs gènes du chromosome 15, ce syndrome fait l’objet de différentes recherches et d’essais cliniques. Récemment, une thérapie génique qui véhicule le gène UBE3A par un vecteur virale AAV laisse entendre des résultats très prometteurs. Si aucun résultat n’est encore publié, d’autres stratégies de thérapie génique visent à réactiver l’UBE3A paternel en réduisant le transcrit antisens UBE3A (UBE3A-ATS), une molécule qui fait taire l’UBE3A paternel.

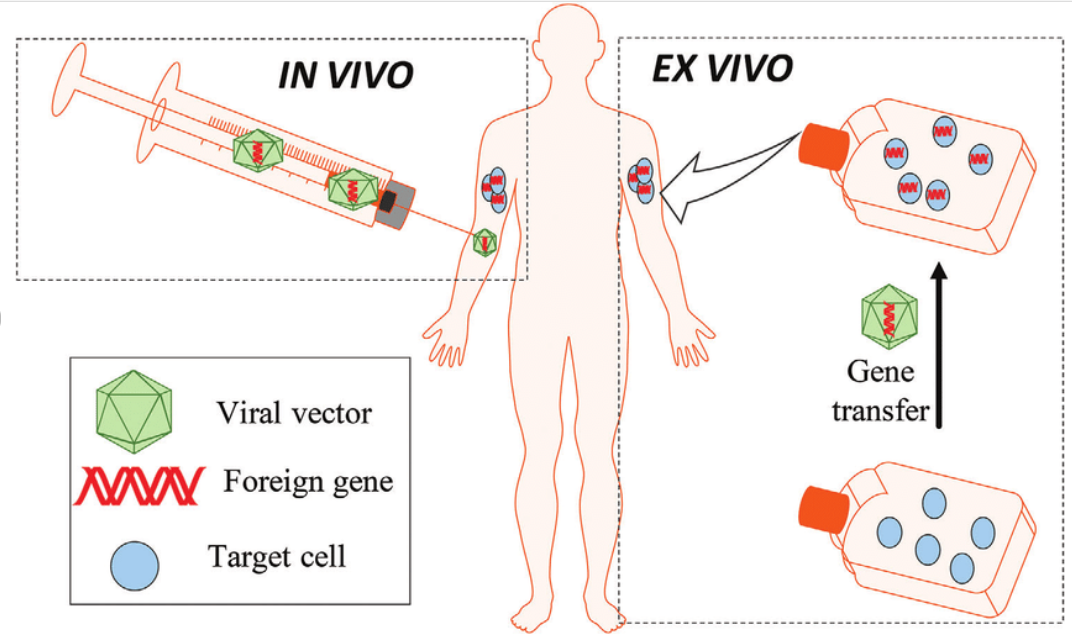
 Tout d’abord, la notion de « thérapie génique » concerne une technique de soin qui se sert de ce qu’on nomme du « matériel génétique » pour soigner une personne. Pour rappel, ce « matériel génétique » correspond à tout ce qui renvoie au caractère génétique de nos cellules. Il s’agit donc d’apporter, au sein de l’ADN d’une personne (son code génétique personnel), une transformation pour la soigner. Comme l’explique un dossier publié par l’Inserm à ce sujet :
Tout d’abord, la notion de « thérapie génique » concerne une technique de soin qui se sert de ce qu’on nomme du « matériel génétique » pour soigner une personne. Pour rappel, ce « matériel génétique » correspond à tout ce qui renvoie au caractère génétique de nos cellules. Il s’agit donc d’apporter, au sein de l’ADN d’une personne (son code génétique personnel), une transformation pour la soigner. Comme l’explique un dossier publié par l’Inserm à ce sujet :